细胞制备中心实验室设计要求
一、总体原则
1、选址、设计布局:应符合《药品生产质量管理规范》、AABB ,质量检测区应符合GB/T 27025 。
2、远程监控:细胞分离纯化、培养扩增、收集冻存、检测质控、细胞复苏、细胞产品运输、设备及环境参数。
3、功能分区
①中心应分为洁净区和非洁净区。
②洁净区至少包含:
更衣区;缓冲区;细胞制备区;细胞培养区;配液区;微生物检测区。
③非洁净区至少包含:
样本接收区;免疫检测区;细胞生物学检测区;理化检测区;物料存放区;清洗消毒区;气体储存区;信息中心区;细胞储存区;档案存放区。
二、建筑要求
1、基本要求
①总建筑面积宜不小于1000m2。
②洁净区使用面积宜不小于500m2。
③洁净室的净高度应在2.5-2.8m之间。
2、总体布局
①总体平面布局应符合GB 19489、GB 50333、GB 50346、GB 50457 的要求。
②洁净区各室布局应清晰合理,不应交叉混合使用,且应符合人、物分流的原则。
③人流通道、洁净区入口应设缓冲室。
④废物、污染物应设置专用传递窗,不应与细胞产品、洁净物品合用一个传递窗。
⑤传递窗送风方式应采用上送侧回的方式。
⑥通道门的开启方向应由低洁净级向高洁净级的方向开启。
⑦所有洁净区不应安装水池和地漏。(除更衣室外)
3、环境要求
①环境设计应符合GB 19489、GB 50346、GB 50457、《药品生产质量管理规范》和AABB
的要求。
②洁净区的环境技术指标应符合以下要求:
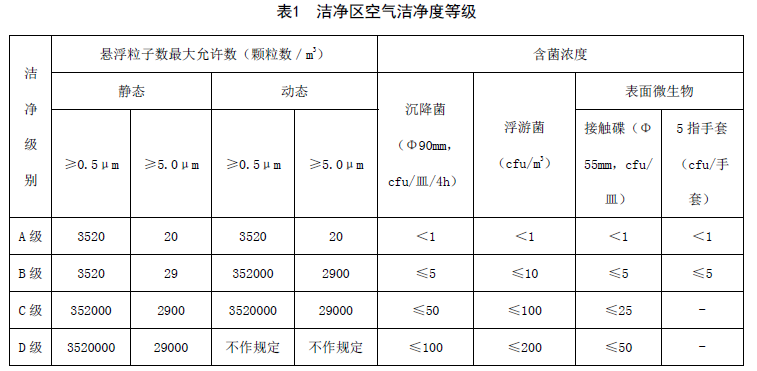
A、空气洁净度等级划分应符合表1 要求;
B、二更、缓冲、细胞制备区、细胞培养区的空气洁净度应符合表1 中的C 级。细胞制备操作相关区域的空气洁净度至少应在C 级背景下的A 级环境中进行;
C、温度应控制在22±4℃,湿度应控制在45%~65%为宜;
D、洁净区与非洁净区之间、不同空气洁净度的洁净区之间的压差应>10Pa。洁净区内不同功能及级别房间之间宜保持适当的压差梯度,以防止污染和交叉污染;
E、总送风量中(非单向流)应有10%~30%的新风量;
F、噪声级(空态)应≤65dB(A) ;
G、般照明的照度值宜>300LX,对照度有特殊要求的区域(细胞产品灯检区)应设置局部照明。